上海交通大学叶坚教授、林俐助理教授团队和新加坡南洋理工大学林歆怡教授团队领衔、全球30多位专家共同参与在ACS Applied Materials & Interfaces上发表表面增强拉曼光谱技术50周年特撰综述。该文入选ACS Editors’ Choice并可免费阅读全文6个月。
英文原题:
Surface-Enhanced Raman Spectroscopy for Biomedical Applications: Recent Advances and Future Challenges
正文:

摘要:
2024年是表面增强拉曼光谱技术(Surface-enhanced Raman spectroscopy, SERS)发现50周年。近年来,SERS技术凭借极高的灵敏度和分子指纹特异性,已成为生物医学领域的重要研究手段。本文是由全球30多位SERS领域知名专家共同撰写的长达93页的大综述,总结了SERS基底、SERS纳米探针、SERS设备和SERS光谱分析四大部分在生物医学应用中的进展和挑战。对于SERS基底,文章强调了胶体和固态两大类基底的重大进展,聚焦于表面化学,热点设计和等离激元3D水凝胶。对于SERS纳米探针,文章综述了包括内嵌缝隙、正交报告拉曼分子和近红外二区响应特性的纳米探针及其表面修饰。对于SERS设备和技术,文章综述了包括光镊、纳米孔和可穿戴式设备等,这类技术可将SERS技术应用于单细胞和单分子分析。对于SERS光谱分析,文章介绍了信号数字化、降噪算法和深度学习等内容,这些信号分析方法显著改善了复杂生物背景中基于拉曼信号的定量分析。最后,文章综述了SERS在核酸检测、蛋白质表征、代谢分析、单细胞监测和活体深穿透拉曼检测等生物医学领域的应用,强调了其在液体活检、代谢表型和细胞外囊泡诊断方面的潜力。文章最后,展望了SERS的临床转化前景和商业化潜力,以及在活体组织深部传感和成像方面的挑战。
SERS技术与发展简介:
表面增强拉曼散射(Surface-enhanced Raman spectroscopy, SERS)技术已成为纳米技术与生物医学交叉领域的重要分析工具。通过利用金属纳米结构的等离激元特性,SERS技术展现出极高的灵敏度,可以在单分子水平上检测到分子指纹信号,能够作为超灵敏分析工具广泛应用于疾病诊断、生物标志物检测、细胞成像和治疗监测等领域。
1974年,基于银基底的SERS技术诞生;在1980年代,SERS开始用于体外生物分子检测,研究重点聚焦于提高灵敏度和解析光谱。1990年代末,单分子SERS的出现再次推动了该技术在生物传感中的应用。2008年,Nie等人首次利用金SERS纳米探针实现活体肿瘤检测,开启了SERS在活体动物研究中的新探索。过去十年,随着纳米材料合成、基底制备工艺和光谱分析技术(特别是人工智能算法)的进步,SERS技术在生物医学中的应用迅速扩展。
一、SERS基底
(一)SERS液相胶体基底:
胶体金/银纳米颗粒易于合成、重现性好且能提供强等离激元效应,是最广泛使用的SERS基底。然而,利用胶体基底进行SERS测试时,确保目标分子特异性吸附在信号增强最有效的“热点”区域是一大挑战。目标分析物可通过直接或间接机制吸附到等离激元基底上(图1),这可通过修饰胶体颗粒的表面化学性质来控制。
通常,纳米颗粒表面覆盖一层配体以防止聚集,但这限制了其仅能检测与配体高亲和力的分子。通过预处理方法(如替换强吸附配体)可拓宽检测范围。此外,弱吸附配体(如柠檬酸盐、氯离子)也可用于稳定纳米颗粒,并实现广泛分析物的检测。间接吸附则需在纳米颗粒表面修饰功能层,以吸引目标分子。常用的修饰剂包括自组装单层、大分子(如抗体、适配体)以及无机材料(如金属有机框架MOFs)。这些修饰剂通过静电、疏水或主客体相互作用增强分析物吸附。
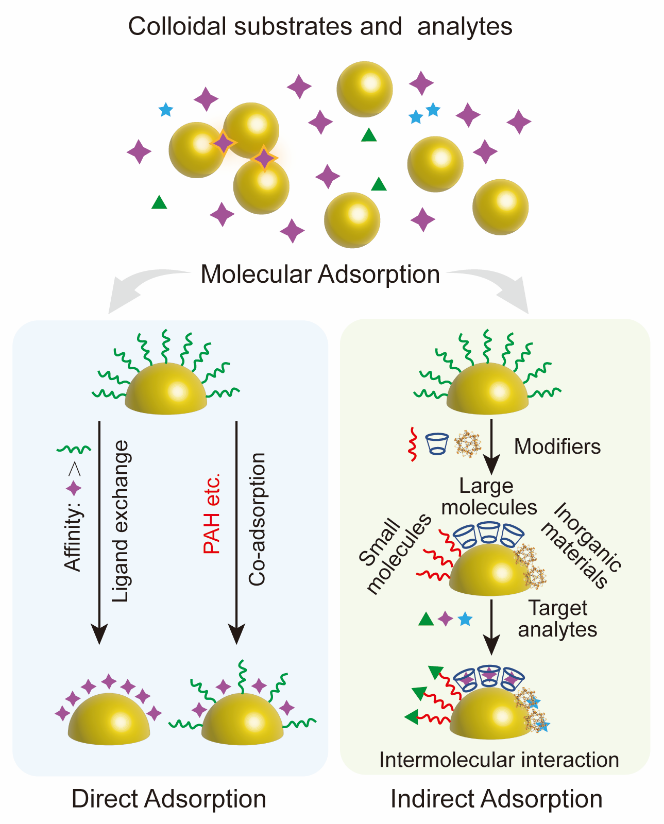
图1. SERS液相胶体基底与待检测物的相互作用方式。
(二)SERS固态基底
(1)3D等离激元水凝胶:
水凝胶因其高吸水性及分子捕获能力,成为结合金属纳米颗粒的理想基底,广泛应用于SERS传感。通过3D生物打印等技术,水凝胶可模拟真实组织环境,支持细胞生长与分化。将SERS纳米探针(如金纳米星或纳米棒)嵌入水凝胶中,可实现高空间分辨率的生物成像,甚至穿透深度超过1000 µm,远超传统荧光显微镜。水凝胶-SERS平台在肿瘤模型、药物扩散监测等领域展现出巨大潜力。
(2)金属有机框架(MOFs):
MOFs作为SERS基底,具备高比表面积、孔径可调节及可调控的局部化学环境等独特优势。通过将等离激元纳米颗粒封装在MOF壳层中,可增强SERS信号的稳定性与灵敏度。MOFs的疏水性设计还可捕获非极性分子,提升检测效率,在环境监测、药物释放动力学研究等领域具有广泛应用前景(图2)。
(3)半导体SERS基底:
半导体材料(如金属氧化物、硫化物)通过电荷转移(CT)和电磁增强机制(EM)提升SERS性能。通过掺杂、异质结设计或微纳结构调控,可显著增强SERS信号。半导体SERS基底还兼具催化功能,如光催化和纳米酶活性,为生物医学检测提供了新工具。例如,MnCo₂O₄纳米管结合SERS与氧化酶催化特性,实现了超灵敏的分子检测。
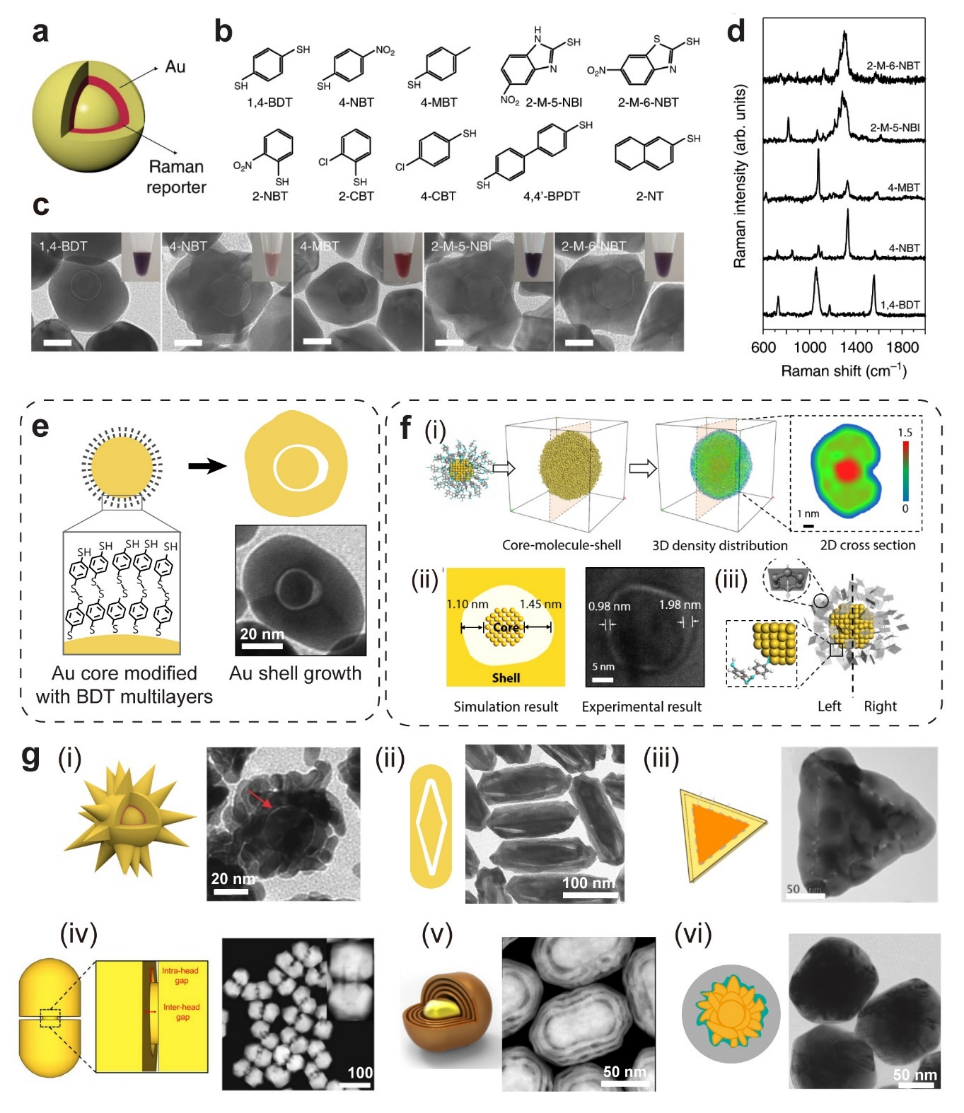
图2. MOFs作为SERS基底的应用。
二、SERS纳米探针:
SERS纳米探针(SERS nanotags)由贵金属纳米颗粒、拉曼报告分子、保护层和修饰层组成,用于增强拉曼信号以实现生物分子的高灵敏度检测。贵金属纳米颗粒通过电磁场增强机制放大拉曼信号,而拉曼报告分子则提供独特的光谱指纹。保护层(如硫醇-PEG、二氧化硅)提升纳米探针的稳定性和生物相容性,修饰层则通过生物识别分子(如抗体、适配体)实现特异性结合。
(一)缝隙增强拉曼探针(GERTs):
其结构通常由金属核、金属壳和中间的拉曼活性隔离层组成。GERTs具有以下优势:间隙内的等离激元耦合效应使其具有超高亮度;拉曼报告分子被金属壳保护,具有优异的胶体稳定性和信号光稳定性;即使在聚集状态下也能保持稳定的SERS响应,适用于定量拉曼分析;通过在内置间隙中嵌入多个拉曼分子或在不同间隙层中嵌入不同分子,可实现多重编码。GERTs已广泛应用于信息安全、快速成像、生物传感、活体检测与成像以及多功能诊疗等领域(图3)。
(二)正交拉曼报告分子:
在复杂生物系统中,正交拉曼报告分子(如含炔基、叠氮基的分子)在1800-2800 cm⁻¹的“生物拉曼透明窗口”中表现出独特的光谱特征,避免了内源性分子的干扰。这些分子通过强亲和力与纳米颗粒表面结合,提供高信噪比的拉曼信号,广泛应用于多通道检测和多目标成像。
(三)NIR-II SERS纳米探针:
近红外二区(NIR-II,1000-1700 nm)SERS纳米探针因其深层组织穿透能力和高空间分辨率,成为活体光学检测和成像的理想工具。通过设计各向异性的贵金属纳米结构(如金纳米棒、纳米壳、银纳米笼)和匹配的拉曼报告分子,NIR-II SERS纳米探针在肿瘤检测和淋巴结失踪中展现出卓越性能。
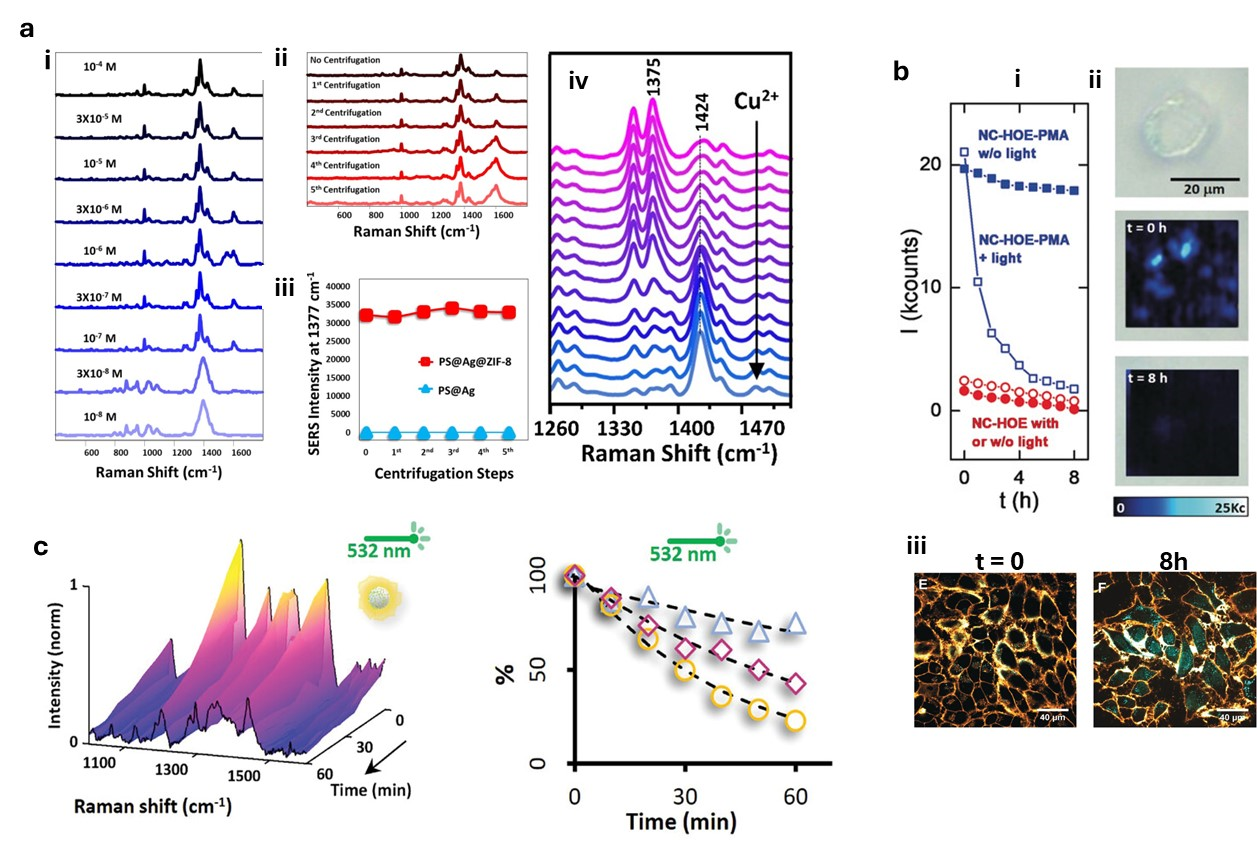
图3. 缝隙增强拉曼探针。
三、新型SERS检测设备与技术:
(一) 光镊在单颗粒和单细胞SERS中的应用
光镊技术通过聚焦激光束操控微米和纳米尺度的物体,抑制布朗运动并精确定位,已与微流控系统结合,显著提升了SERS测量的效率和可重复性。
在微米尺度物体操控中,研究人员设计了部分银包覆的二氧化硅微球作为可光学捕获的SERS移动探针,用于细胞膜的空间扫描检测。在纳米尺度操控中,通过光学聚集多个金属纳米颗粒形成动态热点,显著提升了SERS信号。
(二)等离激元纳米孔系统用于单分子SERS传感:
等离激元纳米孔通过将传统纳米孔与等离激元效应结合,利用贵金属在纳米孔内产生增强电磁场的“热点”,外部电场则促进单分子在热点中的捕获、分析和释放,从而同时测量单个分子的电信号和拉曼信号。例如,研究人员通过聚焦离子束制造了金碗状纳米孔,利用电渗流和电泳力展开DNA并引导其通过热点,成功实现了DNA碱基的单分子SERS检测。
(三)基于SERS的可穿戴检测设备:
可穿戴传感器能够非侵入性地实时监测体液中的生化物质,为早期疾病诊断和个性化健康管理提供了新途径。基于SERS的可穿戴汗液传感器通过利用SERS的高灵敏度和多重检测能力,实现了对电解质、代谢物、激素和药物等多种分子的监测(图4)。
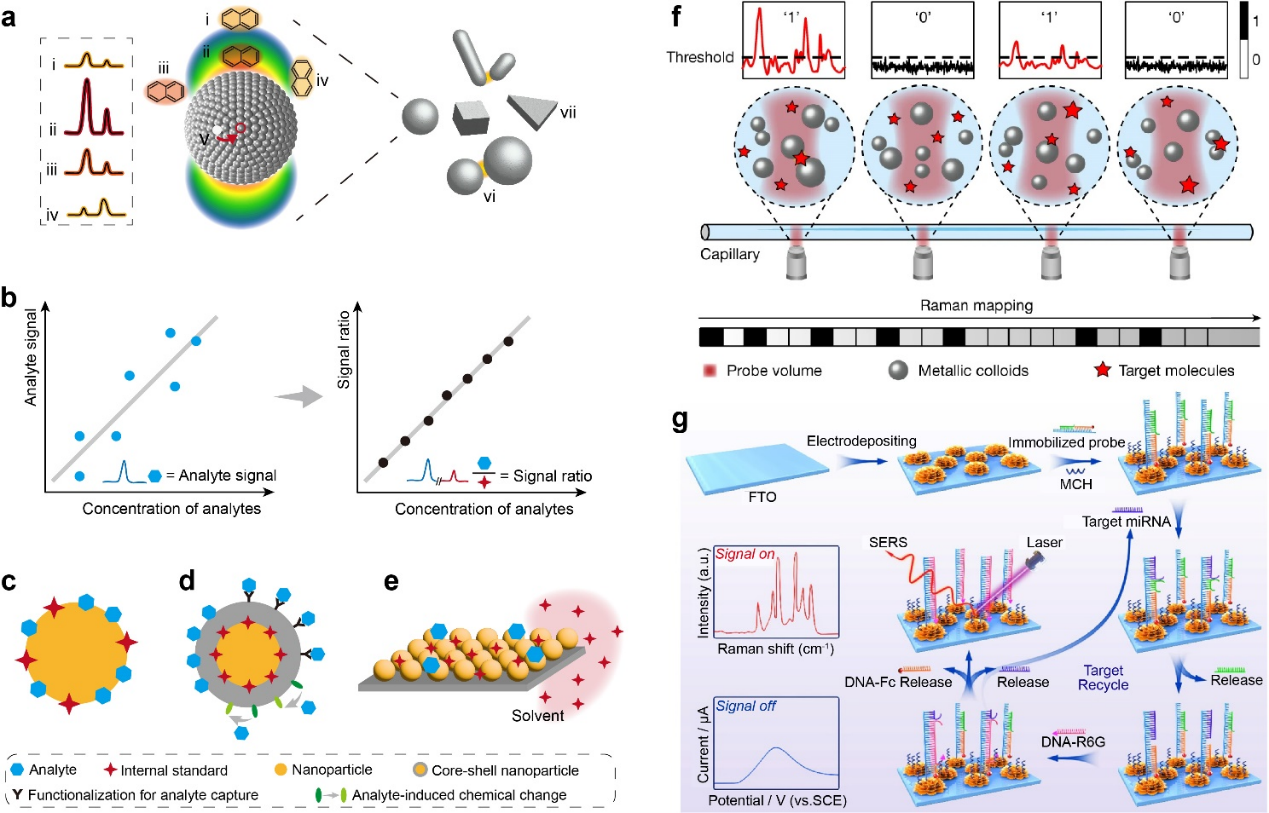
图4. 基于SERS的可穿戴检测设备。
四、SERS数据处理与信号分析
(一)SERS频谱分析
SERS频率反映了激发激光与发射光子之间的能量差异,对应于特定的分子振动。这些振动形成了一个SERS光谱,编码了详细的分子信息。
(1) 基于机器学习的频移分析
由于机器学习(ML)能够处理大量数据并识别复杂模式,它在SERS频率分析中变得越来越重要。ML算法可以分为无监督(PCA、UMAP和HCA)和监督学习方法(PLS、SVM和RT)。而通过SHAP(Shapley Additive Explanations)等算法识别影响模型预测的关键光谱特征等手段可提高机器学习模拟的可解释性。
(2)SERS降噪:
噪声影响SERS光谱质量和成像清晰度。降噪算法已从传统的信号处理方法发展到先进的深度学习技术。相较于传统的傅里叶变换滤波等,PEER(Peak Extraction and Retention)和P2P(Peak2Peak)等自监督深度学习方法通过保留峰信息并减少噪声来提高去噪性能。
(3)SERS光谱解混:
光谱解混涉及将混合的SERS光谱分离成单个成分(端元)及其相对丰度。传统方法如非负最小二乘(NNLS)假设线性混合,但深度学习提供了更准确和灵活的解决方案。如自编码器:这些网络将光谱数据映射到丰度值并重构光谱,提高了解混的准确性。其他架构如卷积神经网络(CNN)、U-Net和Transformer等模型也在光谱解混方面显示出前景。
(二)SERS定量分析:
尽管SERS具有极高的灵敏度,但其信号强度的高度局部化和不均匀性导致了定量分析中的不可重复性问题。多种新兴技术已被开发用于改善定量分析的重复性和可靠性(图5)。
(1)内标法
内标法(IS)是一种在分析化学中长期使用的校准方法,用于校正信号波动。在SERS中,内标分子被用来校正热点增强因子、基底-分子相互作用和仪器差异等变量。例如,罗丹明6G的同位素标记分子被用作内标,以校正不同探针体积、基底批次和测量条件下的增强因子。
(2)数字化SERS技术(dSERS)
随着分析物浓度的降低,SERS单分子信号波动(SIFs)变得越来越显著。数字SERS通过将模拟信号转换为数字信号,避免了模拟信号强度的波动,仅关注二进制状态(1或0)。例如,Bi等人提出了基于胶体的单分子检测方法,即数字胶体增强拉曼光谱(dCERS),在胶体系统中,单分子事件遵循泊松分布,从而在超低浓度下实现了高重复性和测量精度。
(3)双模态SERS传感
SERS定量分析可以通过集成不同的传感模式来提高灵敏度和选择性。电化学-SERS(EC-SERS)通过施加电压增强分析物与金属纳米结构电极表面的相互作用,从而提高检测灵敏度。例如,Zhou等人设计了一种基于EC-SERS的传感器,用于检测miRNA,其检测限分别达到2.2 fM(电化学模式)和0.12 fM(SERS模式)。
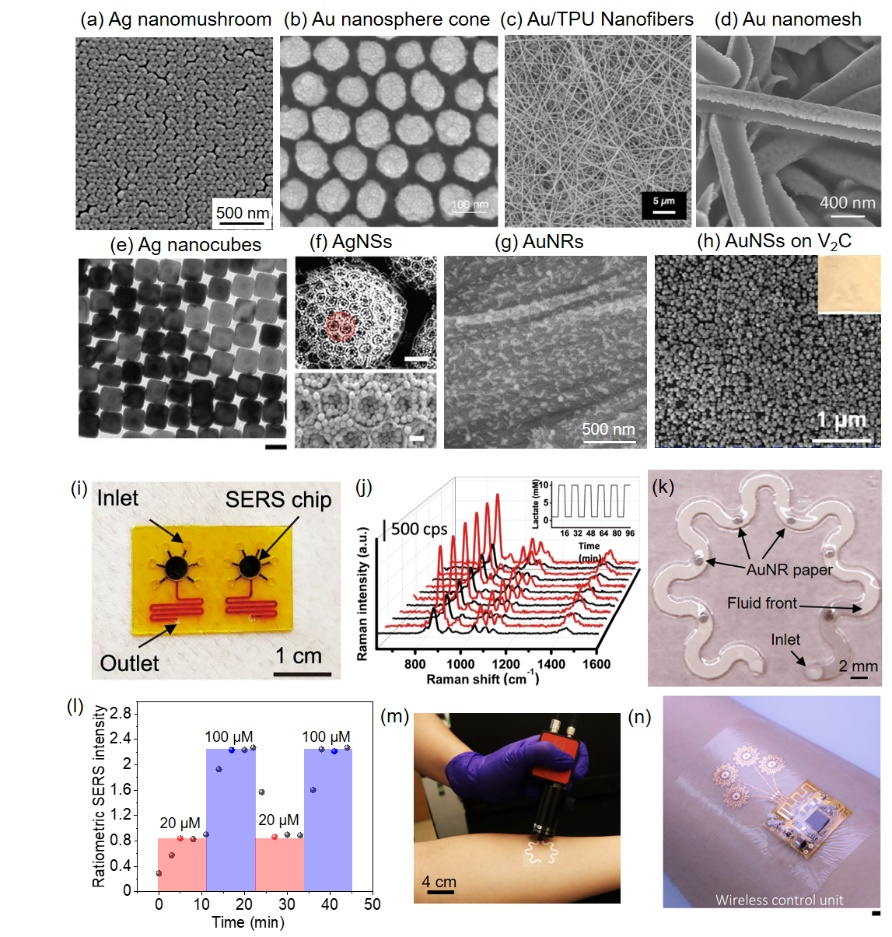
图5. SERS定量分析方法。
五、SERS技术在生物医学中的应用
(一)核酸多通路检测
通过设计特定的SERS纳米探针,可以实现对多种核酸的同时检测。例如,通过磁性微球捕获多种miRNA后,进行多重SERS标记,在待检测miRNA存在的情况下形成核心-卫星复合结构,该方法允许同时检测三种miRNA生物标志物:miR-21, miR-122和miR-223,检测限分别达311,349和374 aM。
(二)蛋白质结构表征与功能预测
SERS技术能够通过拉曼光谱的指纹特征,揭示蛋白质的二级和三级结构信息。通过将蛋白质吸附在SERS活性基底上,可以获得其振动光谱,进而分析蛋白质的构象变化和功能状态。这种方法在蛋白质折叠、酶活性研究和药物-蛋白质相互作用等领域具有广泛应用。而通过分析蛋白质的拉曼光谱特征,可以建立模型来识别不同种类的蛋白质,甚至预测其功能。
(三)基于SERS检测的蛋白质生物标志物液体活检
SERS技术在液体活检中的应用,特别是在血液、尿液等体液中检测蛋白质生物标志物,展现出高灵敏度和特异性。如将等离激元材料和内标嵌入测流层析试纸条中,可用于蛋白质生物标志物的双通道检测;采用多路无泵的微流控芯片,基于SERS信号实现跨多个样品的蛋白质生物标志物双通道检测(图6)。
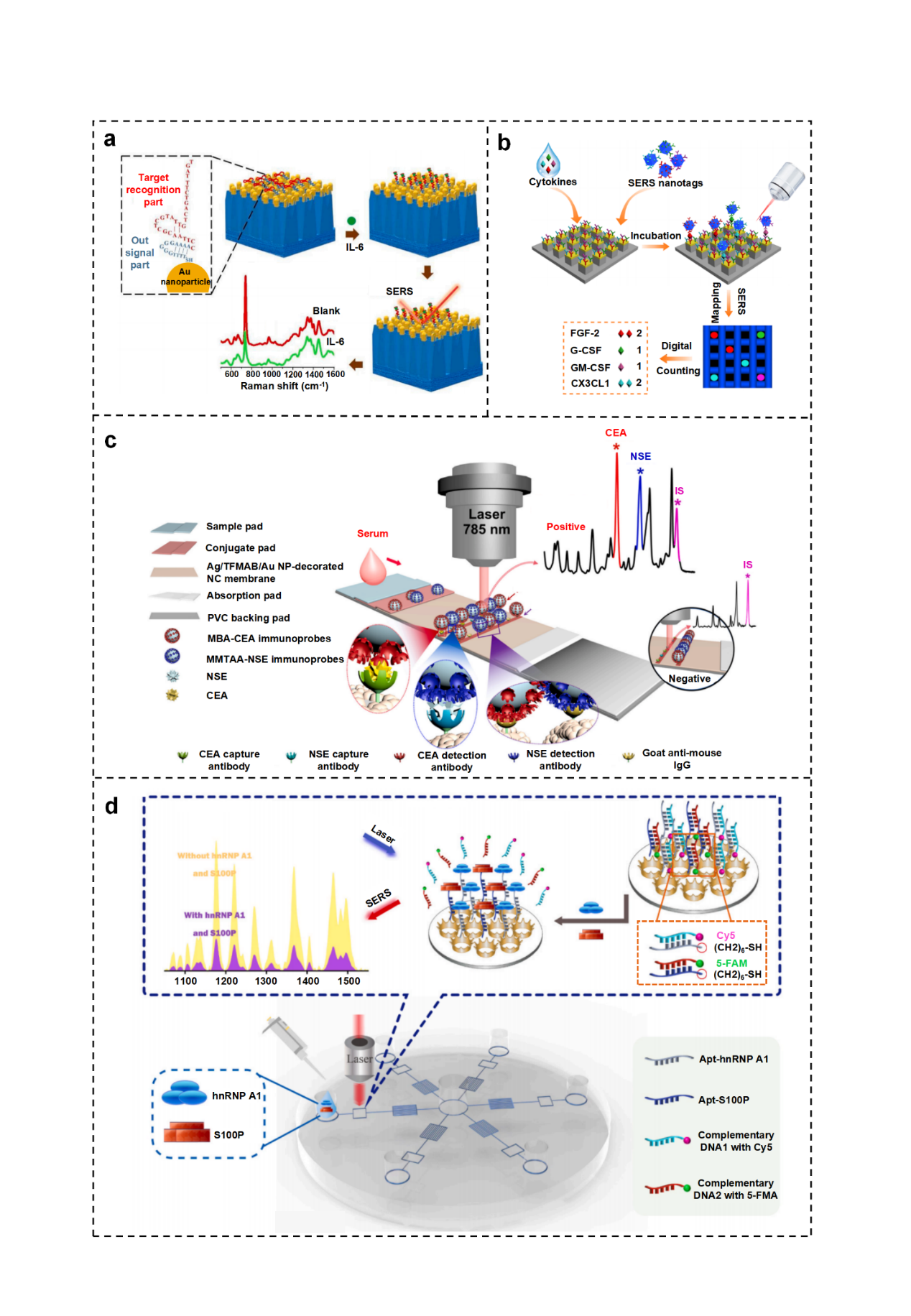
图6. 基于SERS检测的蛋白质生物标志物液体活检。
(四)代谢物SERS分析
SERS技术可以用于检测和定量分析生物体内的代谢物,如葡萄糖、乳酸等。通过将代谢物吸附在SERS活性基底上,可以获得其拉曼光谱,进而分析其浓度变化。
SERSome是一种基于SERS技术的新型代谢分析方法,其使用整个光谱集(可达数百张光谱)而不是单个光谱或少数光谱的平均值,来保存可能捕获的所有分子信息,增强识别生物标志物和分辨不同代谢状态的能力(图7)。
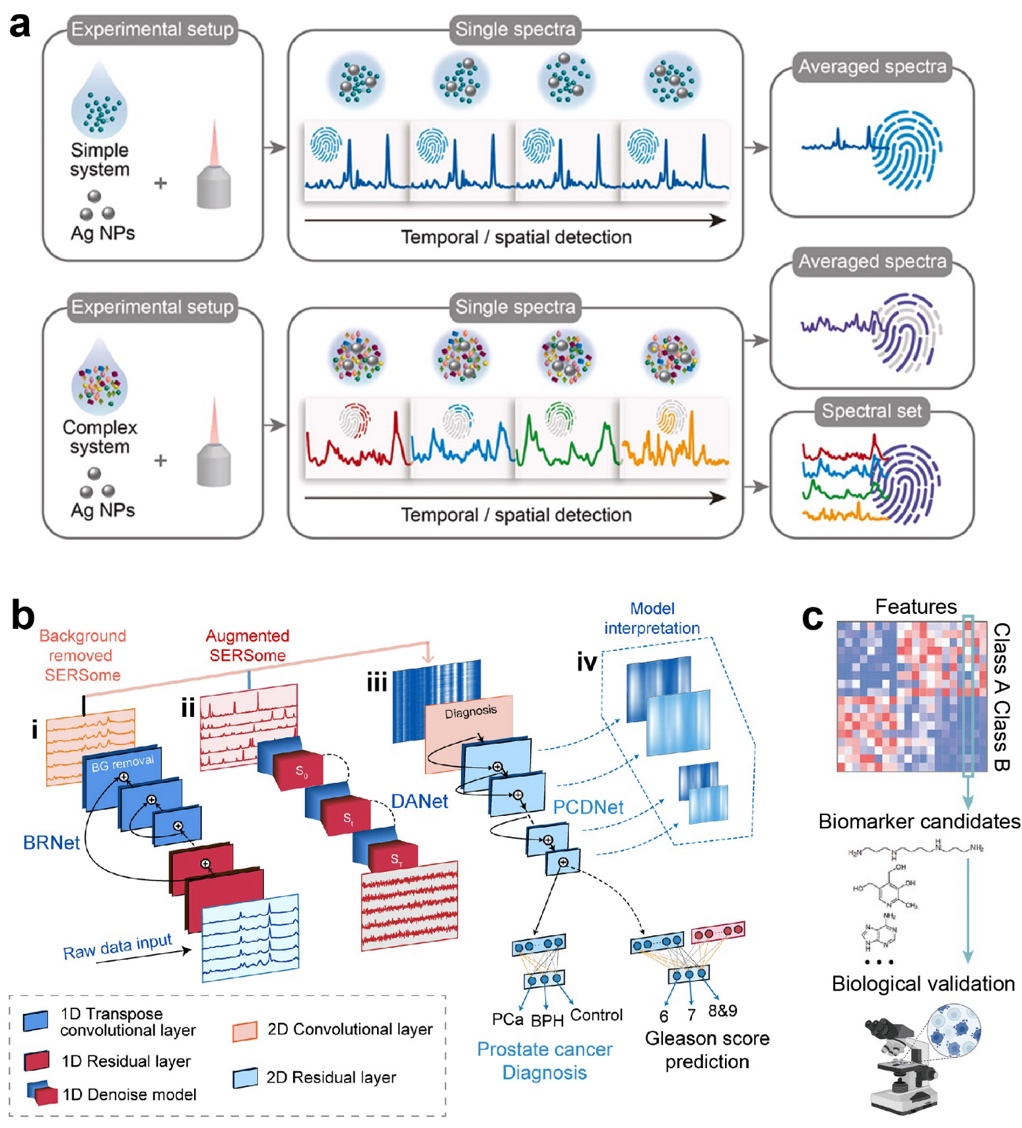
图7. 基于SERSome的代谢检测。
(五) 单细胞代谢物SERS监测
SERS技术能够在单细胞水平上监测代谢物的动态变化,揭示细胞代谢的异质性和动态变化。在微滴-SERS平台上嵌入磁/等离激元复合纳米颗粒(Fe3O4@AgNPs),可实现对单细胞分泌代谢物的无标记检测。纳米颗粒在微滴内自发聚集形成多尺度热点结构,显著增强了热点中代谢物的拉曼信号,可实现对于丙酮酸、乳酸和三磷酸腺苷的同时监测。
(六)细胞外囊泡的SERS监测与诊断
细胞外囊泡(EVs)是细胞间通信的重要媒介,其携带的分子信息可以反映细胞的生理和病理状态。SERS技术可以用于EVs的表面分子检测,揭示其来源和功能,可应用于癌症诊断和液体活检。例如,基于等离激元纳米材料可以检测表皮生长因子受体(EGFR)突变,这种可反应于循环EVs中的突变可用于筛选30多种癌症。最近的另一项研究将EV-SERS应用于六种癌症类型的早期诊断,其灵敏度达90.2%,特异性达94.4%。
(七)空间偏移拉曼光谱及透射拉曼光谱技术实现活体深层检测
空间偏移拉曼光谱及透射拉曼光谱统称为深穿透拉曼光谱技术,通过在空间上将检测探头和激发光源隔开进行检测,抑制浅表背景对深层信号的干扰,可实现深层组织中拉曼信号的检测。结合SERS和深穿透拉曼光谱技术,目前已实现在符合临床安全光照标准的前提下穿透数厘米生物组织进行检测,并基于此实现活体动物(恒河猴、新西兰兔和大鼠等)深部前哨淋巴结的无创示踪和三维定位(图8)。
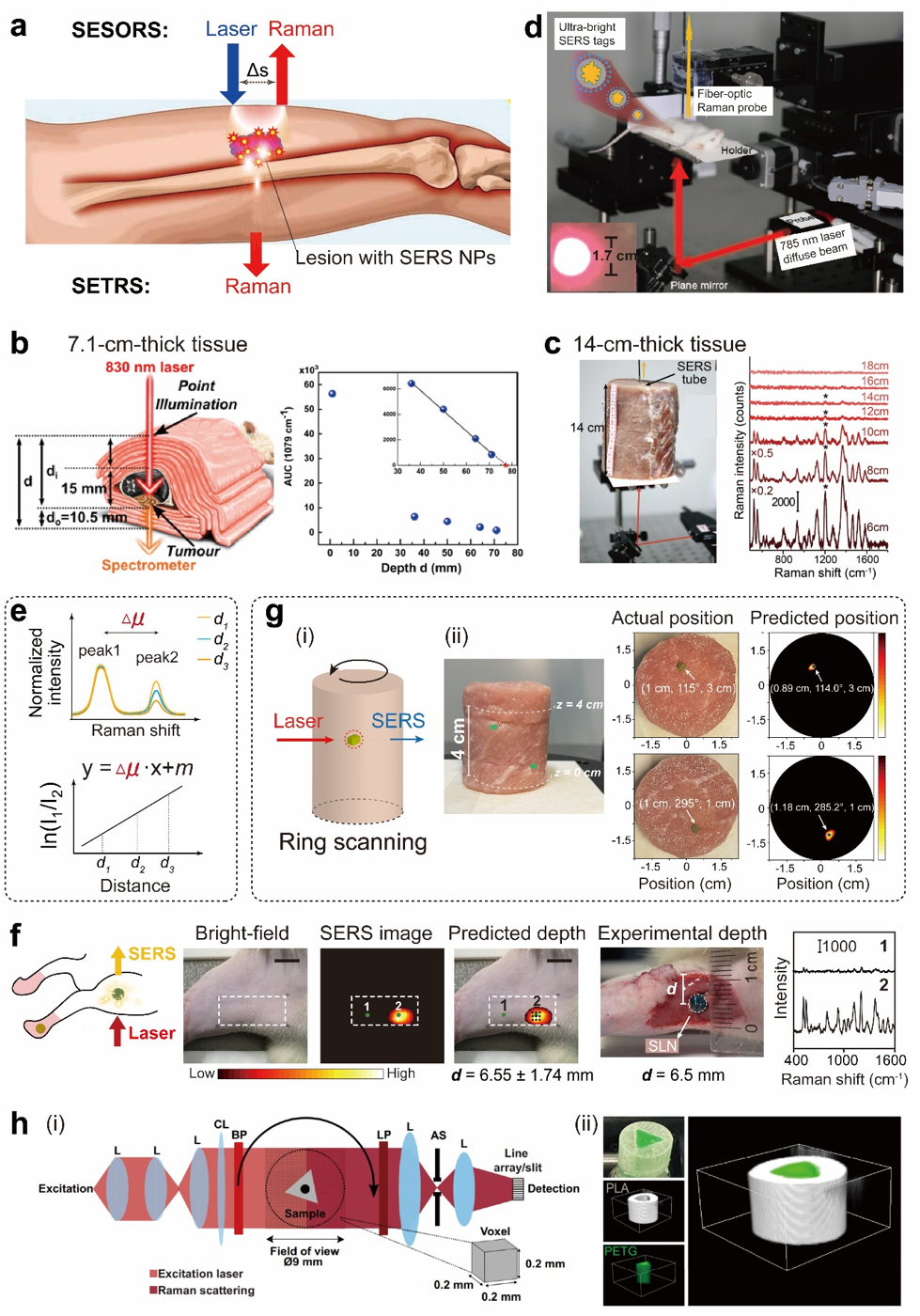
图8. 基于深穿透拉曼光谱检测技术的组织深层检测。
总结与展望:
表面增强拉曼散射(SERS)技术在生物医学领域展现出多个新兴趋势和机遇。首先,SERS具有无需标记的特性,可用于检测和区分血液和组织活检中的复杂生物标志物,如核酸、蛋白质和代谢物分子,并结合人工智能或数字SERS技术实现单分子计数。此外,高生物相容性SERS编码纳米探针在体内肿瘤成像和手术引导中的应用前景广阔。
然而,SERS在医学应用中也面临一些固有挑战。其一,SERS在特定组织位点的测量能力出色,但通常只能逐点采集光谱。通过与CT、MRI、PET等宽场成像技术结合,可以弥补这一局限。另一个挑战是金纳米颗粒(Au NPs)作为SERS探针在体内的长期存留和安全性问题。这些纳米颗粒被肝脏、脾脏等网状内皮系统器官快速摄取后,可能在体内滞留数月甚至数年。尽管“可排泄”金纳米簇的开发前景良好,但其表面涂层和标记物的长期临床安全性和有效性仍需系统评估。
通讯作者简介:
叶坚,PC28开奖网 教授和副院长、国家级青年人才、国家自然科学基金委优秀青年基金获得者、国家重点研发计划项目首席科学家、上海市颠覆性技术创新专项首席科学家、上海市东方英才计划领军项目获得者。在Nature、Nature Communications、Cell Reports Medicine、Advanced Science、Nano Letters、ACS Nano等期刊上发表高水平论文130余篇,被引用6400多次,H因子为45。
林歆怡(Xing Yi Ling),教授,现任新加坡南洋理工大学化学、化学工程和生物技术学院教授。英国皇家化学会会士,ACS Applied Materials&Interfaces家族期刊主编。。主要从事纳米功能材料及表面增强拉曼散射方向的研究工作,研究成果在环境、医疗和催化领域均取得应用。作为第一/通讯作者已在Sci. Adv.、Nat. Commun.、J. Am. Chem. Soc.、Angew. Chem. Int. Et.、Adv. Funct. Mater.等化学和材料领域的国际著名期刊上发表高水平学术论文140余篇,引用13000余次,H因子为48。
团队网站://lingxingyi.jiangnan.edu.cn/
第一作者简介:
林俐,长聘教轨副教授,博导,上海市晨光学者。曾获SERS国际会议最佳墙报奖、IMCO国际会议最佳论文奖等。研究方向是基于拉曼光学方法的无创病灶定位和重建,开发活体透射拉曼光谱技术,实现了深穿透检测、定位和成像等一系列研究。在Nano Letter’s, ACS Nano, Advanced Science, Small Methods,等期刊上发表高水平论文,被引1400余次。
出版信息:
//doi.org/10.1021/acsami.4c17502
Published February 24, 2025
原文链接://pubs.acs.org/doi/full/10.1021/acsami.4c17502